Cada mañana, cuando llego a mi despacho en el Jardín Botánico, conecto el cargador del móvil a mi pecera. Un rato después está tan cargado como si lo hubiera conectado a un enchufe doméstico.

El secreto está en el trabajo de las bacterias electrogénicas que transforman la pecera en una celda de combustible microbiana (CCM), cuyo fundamento es el mismo de las pilas o baterías convencionales.
Para avanzar hacia la descripción de una celda de combustible microbiana resulta apropiado recordar el funcionamiento de una pila convencional (Figura 1). La mayoría de las pilas (o de las baterías de los dispositivos móviles) tienen tres componentes fundamentales: electrodos, electrolito y separador.
Cada batería tiene dos electrodos:
- El cátodo, conectado al extremo positivo de la pila (+), es por donde la corriente eléctrica sale cuando la pila se utiliza para alimentar algo.
- El otro electrodo, el ánodo, está conectado al extremo negativo de la pila (-) y es por donde la corriente eléctrica entra (o los electrones salen) de ella durante la descarga.
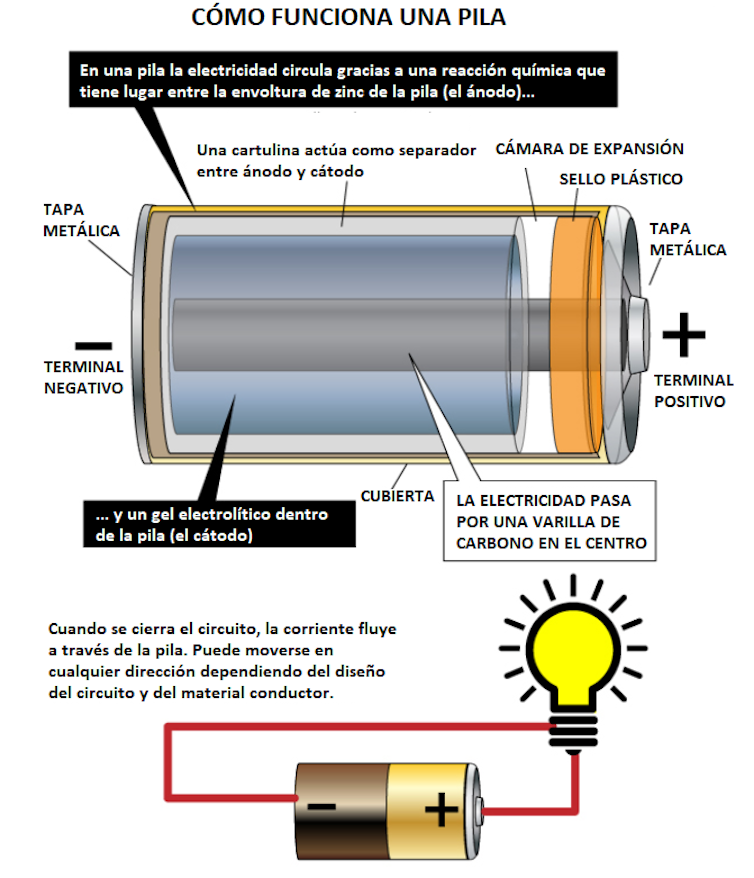
Entre estos electrodos está el electrolito. Es una sustancia líquida gelificada que contiene iones o partículas cargadas eléctricamente. Los iones se combinan con los materiales que componen los electrodos produciendo reacciones químicas que permiten que una batería genere una corriente eléctrica. La función del separador es mantener el ánodo y el cátodo aislados entre sí dentro de la batería para evitar que los dos electrodos entren en contacto y se produzca un cortocircuito.
Celda de combustible microbiana
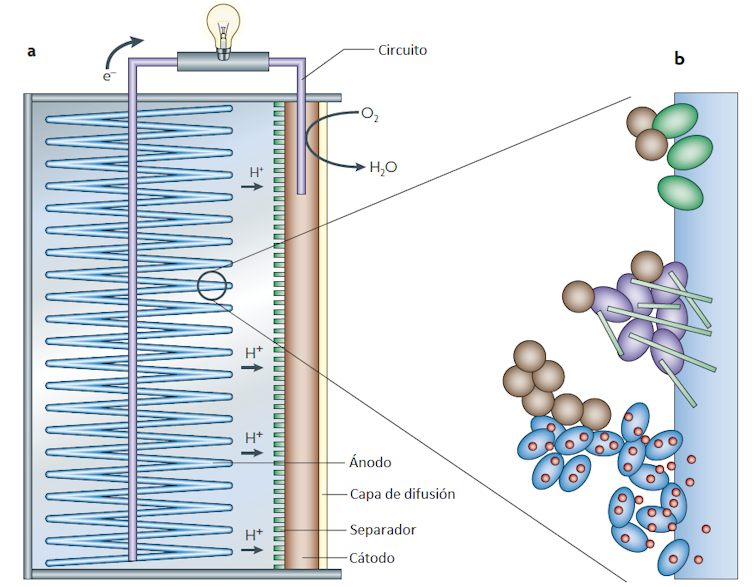
Veamos ahora un esquema de una celda de combustible microbiana (Figura 2), un dispositivo donde se utilizan determinados microorganismos para convertir la energía química presente en sustratos biodegradables (cualquier forma de materia orgánica disuelta) en energía eléctrica. Los organismos capaces de transformar energía química en corriente eléctrica son las bacterias electrogénicas.
La capacidad de las bacterias de producir electricidad fue descrita por primera vez en 1911 por M. C. Potter, profesor de Botánica de la Universidad de Durham, pero su descubrimiento no llamó la atención de otros científicos hasta la década de los ochenta del siglo pasado, debido en buena parte a la necesidad de buscar nuevas fuentes de energía.
Para que avanzara la investigación en este campo fueron decisivos los descubrimientos de fisiología microbiana relacionados con el transporte de electrones entre bacterias y electrodos y, finalmente, el desarrollo de CCM, cuyo fundamento es el mismo de las pilas o baterías convencionales.
Mediante la oxidación catalítica del combustible en el ánodo y la reducción química en el cátodo, las pilas de combustible convencionales se utilizan para producir electricidad electroquímicamente a partir de muchos productos químicos diferentes.
Electrobacterias
Las celdas de combustible microbianas no requieren el uso de catalizadores metálicos en el ánodo. En su lugar, utilizan bacterias exoelectrogénicas que, al oxidar biológicamente la materia orgánica, producen electrones como parte de su metabolismo normal y los transfieren sin intermediarios al ánodo. Estos electrones fluyen a través de un circuito hasta el cátodo, donde se combinan con protones y con un catolito, es decir, con una sustancia química que, como el oxígeno, es capaz de aceptar electrones.
Esas bacterias producen electricidad generando electrones dentro de sus células y luego transfiriéndolos a través de pequeños canales formados por proteínas de sus membranas celulares en un proceso conocido como transferencia de electrones extracelulares. Las bacterias ceden los electrones producidos metabólicamente a un material conductor, generando una corriente eléctrica.
Convertir este proceso natural en una celda de combustible microbiana funcional es tan simple como llenar un recipiente como mi pecera con lodo, aguas residuales o desechos y esperar a que las bacterias crezcan.
Las electrobacterias más utilizadas son las del género Geobacter, muy abundantes en los sedimentos acuáticos, que presentan características tan interesantes como la producción de electricidad, la descontaminación de suelos y aguas, y la producción de nanocables bacterianos, que pueden emplearse como nanoconductores de los electrones para conducirlos hasta electrodos.
Cuando los miles de millones de bacterias que crecen juntas se combinan, los nanocables se unen para formar biopelículas conductoras que pueden transferir electrones a distancias considerables, lo que abre la posibilidad de desarrollar conductores eléctricos orgánicos y autorreparables para su uso en bioordenadores. Además, esta transmisión directa se favorece por un enorme apilamiento de citocromos, unas proteínas especializadas que facilitan la transferencia.
Estas bacterias son anaeróbicas y en su hábitat natural emplean metales para respirar y obtener energía. De igual manera que son capaces de transferir los electrones a muchos metales, también son capaces de transferirlos a electrodos y así constituir una celda de combustible microbiana. Hay dos principales tipos, las que emplean cultivos aislados en dispositivos controlados en el laboratorio (Figura 2) y las de sedimento, que emplean la materia orgánica de fondos acuáticos (marinos y de agua dulce) para producir electricidad.
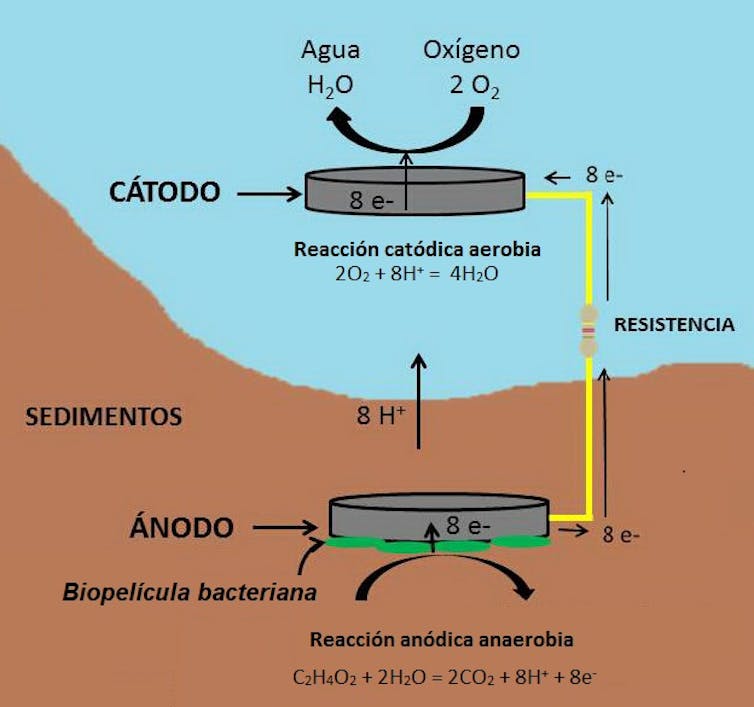
La mía, basado en Geobacter, es simple (Figura 3). En las celdas de combustible microbianas se requiere el contacto del ánodo con el sedimento anaerobio (rodeado de una biopelícula de bacterias exoelectrogénicas), mientras que el cátodo está expuesto en la superficie usualmente saturada o con elevada concentración de oxígeno.
Un electrodo de grafito insertado en el sedimento del fondo recoge los electrones generados por las electrobacterias al descomponer tanto la materia orgánica muerta depositada en el sedimento, como los exudados ricos en ácidos orgánicos emitidos por las raíces de las plantas acuáticas. El circuito eléctrico iniciado en el ánodo se cierra con el otro electrodo, el cátodo, situado en la superficie del agua, de modo que los electrones, el oxígeno y el hidrógeno se combinan para dar agua.
La degradación de los materiales orgánicos produce, además de C0₂, protones (H+). Estos cruzan el medio hasta el segundo electrodo, mientras que los electrones viajan por el circuito externo. Cuando se reduce el oxígeno en el cátodo, el resultado final de la pecera transformada en dispositivo generador de electricidad es que, tomando los electrones del circuito externo y los protones formados en el ánodo, se forme agua.
Para mejorar su rendimiento, en mi pecera el cátodo está situado en un lecho flotante que alberga un consorcio de bacterias que capturan los electrones con mayor eficacia y rapidez que el oxígeno del agua.

Actualmente, las aplicaciones de estos dispositivos son limitadas debido a la baja potencia de salida. La más práctica que utiliza actualmente la Marina de Estados Unidos pesa 16 kilogramos y produce al año la potencia equivalente a 16 baterías convencionales de 1,5 V. Pero no olvidemos que cuando en 1946 se presentó al público el primer ordenador, el ENIAC, era un monstruo de 27 000 kilos, que ocupaba 167 m² y cuyo consumo era de 160 000 W, lo que se conseguía a costa de provocar frecuentes apagones en Filadelfia, donde estaba ubicado.
Y todo para no conseguir ni una millonésima parte de la capacidad de prestaciones que hoy me ofrece el dispositivo que conecto a mi pecera. Cuestión de tiempo.
Manuel Peinado Lorca, Catedrático de Universidad. Departamento de Ciencias de la Vida e Investigador del Instituto Franklin de Estudios Norteamericanos., Universidad de Alcalá
This article is republished from The Conversation under a Creative Commons license. Read the original article.