La diacilglicerol O-aciltransferasa 1 (DGAT1), enzima limitante de la velocidad de biosíntesis de triacilglicerol (TAG), es un objetivo crucial para la ingeniería de plantas con mayor producción y calidad de aceite.
por Zhang Nannan, Academia China de Ciencias
Sin embargo, la estructura de la DGAT1 vegetal y los mecanismos moleculares que subyacen a su catálisis y regulación de la actividad siguen siendo inciertos.
Un grupo de investigación dirigido por el profesor Liu Zhenfeng del Instituto de Biofísica de la Academia China de Ciencias ha resuelto estructuras tridimensionales de alta resolución de la DGAT1 de Arabidopsis thaliana de tipo salvaje (AtDGAT1) y un mutante de baja actividad (H447A) utilizando microscopía crioelectrónica de partícula única.
Por primera vez, los investigadores revelaron los sitios de unión de dos sustratos (DAG y oleoil-CoA), dos productos (TAG y CoASH) y múltiples moléculas de ácidos grasos libres (AGL) dentro de DGAT1. Los hallazgos se publicaron en The Plant Cell el 13 de octubre.
El análisis mutacional mostró que la sustitución de Cys246, un residuo que interactúa con el grupo de cabeza carboxilo de los FFA, con alanina, serina o treonina (C246A/S/T) mejora significativamente la actividad de AtDGAT1.
La estructura crio-EM del mutante AtDGAT1-H447A mostró simetría pseudo-C2, con un monómero uniéndose a los sustratos DAG y oleoil-CoA y el otro uniéndose a los productos TAG y CoASH.
La superposición estructural de las enzimas de tipo salvaje y mutantes reveló que una molécula de FFA ( ácido oleico , OLA) ayuda a estabilizar la cadena de acilo graso y el enlace tioéster del oleoil-CoA en una orientación favorable para la catálisis.
Basándose en los datos bioquímicos y estructurales, los investigadores propusieron un ciclo catalítico para la transferencia de acilo mediado por DGAT1 vegetal.
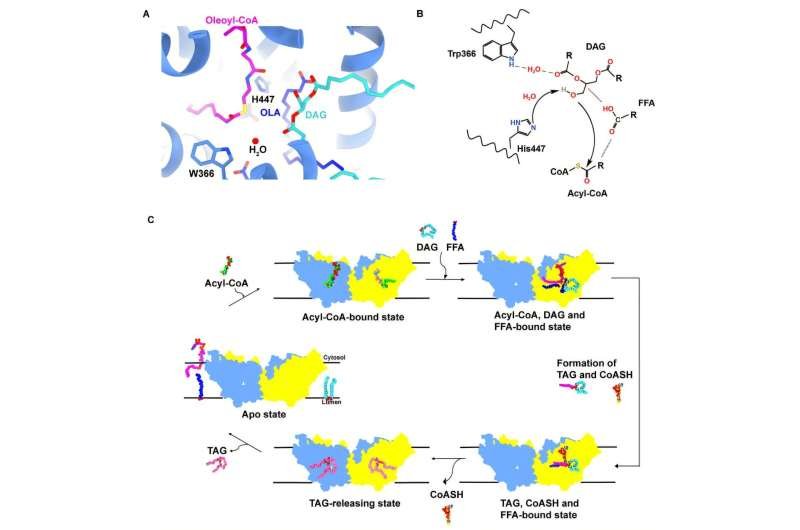
En este modelo, el acil-CoA se enriquece en el dominio N-terminal y entra al sitio activo desde el lado citosólico, mientras que el DAG accede al sitio a través de una abertura lateral de la membrana.
Con la ayuda de los ácidos grasos libres (AGL), los dos sustratos se estabilizan dentro del centro catalítico. Es probable que la His447 desprotone el grupo hidroxilo del DAG a través de una molécula de agua, lo que permite un ataque nucleofílico al enlace tioéster del acil-CoA para producir TAG y CoASH.
Tras un cambio conformacional en el dominio N-terminal del monómero adyacente, la CoASH puede liberarse al citosol, mientras que la TAG sale lateralmente hacia la membrana. Finalmente, la DGAT1 vuelve a su estado inicial sin sustrato.
Mediante la integración de análisis estructurales bioquímicos y crio-EM, este estudio arroja luz sobre el mecanismo catalítico y la regulación de la actividad de DGAT1 en plantas mediada por AGL. Esto proporciona información estructural clave para el mejoramiento genético racional de cultivos oleaginosos con mayor producción de aceite y una mejor composición de ácidos grasos.
Más información: Xiuying Liu et al., Mecanismos estructurales subyacentes a la regulación de la diacilglicerol-O-aciltransferasa 1 mediada por ácidos grasos libres en Arabidopsis, The Plant Cell (2025). DOI: 10.1093/plcell/koaf239
Nota editorial:
Este artículo ha sido elaborado con fines divulgativos a partir de información pública y fuentes especializadas, adaptado al enfoque editorial del medio para facilitar su comprensión y contextualización.
