La modificación genética de los mosquitos para que expresen genes antipalúdicos y los transmitan a su descendencia se está probando como una nueva estrategia para eliminar la malaria.
EureakAlert! .- Alterar los genes del intestino de un mosquito para que transmita genes antipalúdicos a la siguiente generación de su especie resulta prometedor como enfoque para frenar la malaria según sugiere un estudio preliminar publicado recientemente en eLife.
El estudio es el último de una serie de pasos hacia el uso de la tecnología de edición genética CRISPR-Cas9 para realizar cambios en los genes de los mosquitos, lo que podría reducir su capacidad de propagar la malaria. Si otros estudios apoyan este enfoque, podría proporcionar una nueva forma de reducir las enfermedades y muertes causadas por la malaria.
La creciente resistencia de los mosquitos a los pesticidas, así como la resistencia de los parásitos de la malaria a los fármacos antipalúdicos, ha creado una necesidad urgente de nuevas formas de combatir la enfermedad. Los impulsores genéticos (gene drives) se están probando como un nuevo enfoque. Funcionan creando mosquitos modificados genéticamente que, al ser liberados en el medio ambiente, difunden genes que reducen las poblaciones de mosquitos o hacen que los insectos sean menos propensos a propagar el parásito de la malaria. Pero los científicos deben demostrar que este método es seguro y eficaz antes de liberar mosquitos modificados genéticamente en la naturaleza.
«Los impulsores genéticos son herramientas prometedoras para el control de la malaria», afirma la primera autora del estudio, Astrid Hoermann, investigadora asociada del Imperial College de Londres (Reino Unido). «Pero queríamos una vía clara para probar con seguridad esas herramientas en los países donde la enfermedad es más frecuente».
En el estudio, Hoermann y sus colegas modificaron genéticamente el mosquito Anopheles gambiae, transmisor de la malaria. Utilizaron la tecnología CRISPR/Cas9 para insertar un gen que codifica una proteína antipalúdica entre los genes que se activan después de que el mosquito se alimente de sangre. El equipo lo hizo de tal manera que permitió que toda la sección de ADN funcionara también como un «impulsor genético» que pudiera transmitirse a la mayoría de la descendencia de los mosquitos. Inicialmente insertaron el gen junto con un marcador fluorescente para ayudarles a rastrearlo en tres puntos diferentes del ADN, y luego eliminaron el marcador, dejando sólo una pequeña modificación genética.
A continuación, el equipo crió los mosquitos para ver si eran capaces de reproducirse con éxito y mantenerse sanos. También comprobaron el grado de desarrollo del parásito de la malaria en los intestinos de los mosquitos. Sus experimentos aportan pruebas preliminares de que este enfoque de las modificaciones genéticas podría crear unidades genéticas exitosas.
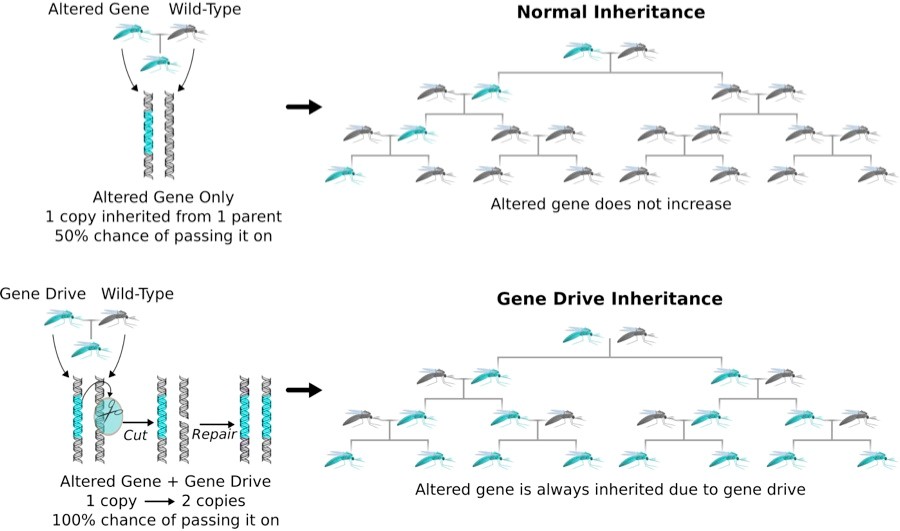
En 2015 científicos estadounidenses modificaron por primera vez los mosquitos transmisores de la malaria utilizando CRISPR para expresar el sistema “gene drive”, una especie de genes “egoístas” dominantes que se extienden rápidamente en la población. Con el control de la malaria a través de “gene drive”, ciertos genes que impiden crecer el parásito de la malaria (los mosquitos en azul), se harán más comunes y con el tiempo se extienden a toda la población.
«Estas modificaciones genéticas son pasivas y podrían probarse sobre el terreno y someterse a un riguroso proceso de regulación para garantizar que son seguras y eficaces para bloquear el parásito sin que surjan problemas de propagación accidental en el medio ambiente«, explica el autor principal, Nikolai Windbichler, profesor titular del Departamento de Ciencias de la Vida del Imperial College de Londres. «Sin embargo, una vez que los combinamos con otros mosquitos con un impulsor genético activo, se convierten en impulsores genéticos por sí mismos sin necesidad de más cambios. Así, nuestro enfoque acerca los impulsos genéticos un paso más hacia su ensayo en el campo como estrategia de eliminación de la malaria.»
- Fuente: https://www.eurekalert.org/pub_releases/2021-04/e-sgm041321.php
- Estudio: https://elifesciences.org/articles/58791
